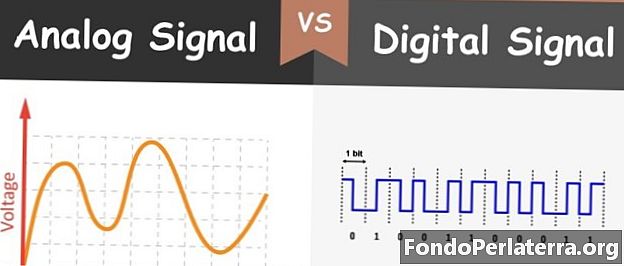
Alpha Helix vs. Beta laskostettu arkki

Sisältö
- Sisältö: Ero Alpha Helix- ja Beta-laskoslevyjen välillä
- Vertailutaulukko
- Mikä on Alpha Helix?
- Mikä on Beta-laskostettu arkki?
- Keskeiset erot
Aihe, joka sijaitsee proteiinien sekundaarisessa rakenteessa ja tulee vakiona kelamaisena tai spiraalisena oikeanpuoleisena vahvistuksena, joka antaa sille erotuksen kierroksesta, joka siis tunnetaan yleisesti alfa-kierroksena. Toisaalta beeta-laskostettu arkki, jota kutsutaan myös b-arkkiksi, määritellään proteiineissa läsnä olevan ominaisen sekundaarisen rakenteen standardimotiiviksi.

Sisältö: Ero Alpha Helix- ja Beta-laskoslevyjen välillä
- Vertailutaulukko
- Mikä on Alpha Helix?
- Mikä on Beta-laskostettu arkki?
- Keskeiset erot
- Videon selitys
Vertailutaulukko
| Erottelun perusteet | Alfa Helix | Beta-laskostettu arkki |
| Määritelmä | Aihe, joka sijaitsee proteiinien sekundaarisessa rakenteessa ja tulee vakiona kelamaisena tai spiraalisena oikeanpuoleisena vahvistuksena, joka antaa sille erotuksen kierroksesta. | Beeta-laskostettu arkki, jota kutsutaan myös b-levyksi, määritellään proteiineissa läsnä olevan karakteristisen sekundaarisen rakenteen vakioaiheeksi. |
| Aminohappoja | Aminohappojen -R-ryhmät ovat ulkopinnalla. | -R-ryhmät ovat levyn ulkopuolella ja sisäpinnalla. |
| liimaus | Vety sidokset syntyvät polypeptidiketjussa kierteisten rakenteiden luomiseksi. | Ole olemassa yhdistämällä kaksi tai useampia kuin beeta-juosteita vety sidoksista. |
Mikä on Alpha Helix?
Aihe, joka sijaitsee proteiinien sekundaarisessa rakenteessa ja tulee vakiona kelamaisena tai spiraalisena oikeanpuoleisena vahvistuksena, joka antaa sille erotuksen kierroksesta, joka siis tunnetaan yleisesti alfa-kierroksena. Tässä rakenteessa N-H-ryhmä merkitsee vedysidosta C = O-ryhmään, jota kutsutaan aminohappojen runkoksi, joka tulee läsnä neljään tähteeseen ennen proteiinisekvenssiä. Kaksi keskeistä edistystä nykypäivän α-helixin osoittamisessa olivat: oikea sidosgeometria aminohappojen ja peptidien arvokkaiden kivirakenteiden arvioiden ja Paulingin odotusten mukaan tasomaisten peptidisidosten vuoksi; ja hänen luopumisensa epäilystä tarpeellisesta määrästä talletuksia kierukan kierrosta kohti. Elävä minuutti tuli aikaisin keväällä 1948, kun Pauling tuli alas virheen kanssa ja meni nukkumaan. Väsyneenä hän piirsi paperinpalalle polypeptidiketjun, joka sisälsi yleensä oikeat mittaukset, ja romahti sen kierreksi pitäen mielessä pitääkseen tasossa olevat peptidisidokset. Alfa-kierre on tunnetuin luonnossa löydetty kierre. Se käsittää haavan polypeptidiketjun, jossa aminohappojen sivuketjut laajenevat keskustasta ulospäin, mikä antaa sille mahdollisuuden pitää muodonsa. Niitä löytyy monenlaisista proteiineista, globaaleista proteiineista, esimerkiksi myoglobiinista, keratiiniin, joka on jäykkä proteiini. Se voi olla joko annettu etuoikeus tai vasemmanpuoleinen helice, mutta on osoitettu, että alfa-kierrepiiriä tuetaan, koska sivuketjut eivät ole ristiriidassa. Tämä tieto antaa alfa-heeliksin vakauden. Jokaisessa alfa-kierukan kiharassa on 3,6 amino-syövyttävää kerrostumaa.
Mikä on Beta-laskostettu arkki?
Beeta-laskostettu arkki, jota kutsutaan myös b-levyksi, määritellään proteiineissa läsnä olevan karakteristisen sekundaarisen rakenteen vakioaiheeksi. Erotuksesta, joka sillä on muihin proteiineihin verrattuna, tulee se tekijä, että se koostuu säikeistä, joilla on yhteys ainakin kahden tai kolmen vetyatomin kanssa, jotka ovat rakenteessa, joka muodostaa laskostetun levyn. P-juoste on määrä polypeptidi-ankkuria, joka on säännöllisesti 3-10 aminohappoa pitkä selkärangan kanssa laajentuneessa adaptaatiossa. Β-arkkien supramolekulaarinen suhde on juurtunut monien ihmisten sairauksien, etenkin amyloidoosien, esimerkiksi Alzheimerin sairauden, näkemien proteiinisummien ja -fibrillien järjestelyyn. Tämä rakenne tapahtuu, kun polypeptidiketjun kaksi osaa peittävät toisiaan ja muodostavat rivin vety sidoksia toistensa kanssa. Tämä toiminta voi tapahtua rinnakkaisen toiminnan aikana tai vihamielisesti samansuuntaisen suunnitelman suhteen. Rinnakkaisesti ja samaa pelisuunnitelmaa vastaan on polypeptidiketjun suuntaviivojen välitön tulos. Vastaava beeta-rypistetyn levyn rakenne on a-rypistetty arkki. Tämä rakenne on innostuneesti vähemmän ihanteellinen kuin beetapohjainen arkki ja on aidosti ennennäkemätön proteiineissa. A-rypistetylle levylle kuvataan sen karbonyyli- ja aminoryhmien kokoonpano; karbonyyliryhmät säädetään kokonaan yhteen otsakkeeseen, kun taas kaikki N-H-ryhmät säädetään toisin.
Keskeiset erot
- Aihe, joka sijaitsee proteiinien sekundaarisessa rakenteessa ja tulee vakiona kelamaisena tai spiraalisena oikeanpuoleisena vahvistuksena, joka antaa sille erotuksen kierroksesta, joka siis tunnetaan yleisesti alfa-kierroksena. Toisaalta beeta-laskostettu arkki, jota kutsutaan myös b-arkkiksi, määritellään proteiineissa läsnä olevan ominaisen sekundaarisen rakenteen standardimotiiviksi.
- Aminohappojen -R-ryhmät esiintyvät kierukan ulkopinnalla, kun taas -R-ryhmät esiintyvät levyn ulkopinnalla ja sisäpinnalla.
- Alfa-kierre on polypeptidiketju, joka on valettu ja kelattu jousimaisella rakenteella, jota pitävät vety sidokset. Toisaalta Beta-laskostetut levyt valmistetaan beeta-juosteista, jotka liittyvät sivua pitkin ainakin kahdella selkärankaa muodostavilla vety sidoksilla.
- Kierukka voi olla vasenkätinen (beeta) tai oikea, jossa alfa-kierre on jatkuvasti oikea. Ketjut päinvastoin, säädetään ketjut vierekkäin naruihin, jotka on järjestetty käänteisesti toisiinsa beeta-laskostettuina levyinä.
- Alfa-heeliksin muodostuminen on olemassa sellainen, että vety sidokset muodostuvat polypeptidiketjussa kierteisten rakenteiden luomiseksi. Toisaalta, beeta-laskostetut levyt ovat olemassa kytkemällä kaksi tai useampia kuin kaksi beeta-juostetta vety sidoksista.